臨床研究法下の管理者(病院長)報告手続き
臨床研究監理センター臨床研究事務局(臨床研究法担当)では、臨床研究法下で実施する特定臨床研究・非特定臨床研究の実施医療機関の管理者(病院長)への報告の受付・許可に関する手続きを担当しております。
ご不明な点がございましたら
臨床研究事務局(臨床研究法担当)
へお問い合わせください。
- 011-706-7934
rinsyokenkyu@huhp.hokudai.ac.jp
(※@マークを小文字の「@」へ変更してメールの送信をしてください。)
※ 本学以外の認定臨床研究審査委員会で承認された研究で病院長の実施許可申請を得る場合は
臨床研究法 審査申請システムからご提出ください。
※以下の(1)~(3)については、統括管理者や研究事務局へ書類提出前(認定臨床研究審査委員会での審査前)にご確認ください。 研究開始前だけではなく、研究実施中~研究終了までの間ご確認が必要です。
(1)臨床研究標準業務手順書
本院にて臨床研究法に則り臨床研究を実施する場合には、臨床研究標準業務手順書に従って実施してください。(2)利益相反の管理
本院にて臨床研究法に則り研究を開始する場合には、事前に「北海道大学病院臨床研究法における利益相反管理に関する標準業務手順書」に則って、利益相反審査委員会による事実確認を受ける必要があります。
また、研究期間中に研究責任医師、統計解析責任者、研究分担医師の追加や変更の際、1年ごとの定期報告をおこなう際、申告内容変更の際にも必要です。
詳細は利益相反審査委員会事務局までお問い合わせください。
-
011-706-8538
coi_review@huhp.hokudai.ac.jp
(※@マークを小文字の「@」へ変更してメールの送信をしてください。)
▶︎▶︎▶︎ 利益相反審査委員会事務局HP
(3)教育及び訓練
研究責任医師及び研究分担医師は、研究開始前に臨床研究を適正に実施するための十分な教育及び訓練を受けることが必要です。(臨床研究中核病院が実施する臨床研究に従事する者を対象とした研修(臨床研究・治験従事者研修等)及びそれに準じた内容の研修が該当します。単に学術集会に参加したのみでは該当しません。)
詳細は臨床研究事務局(臨床研究法担当)までお問い合わせください。
統括管理者が作成し認定臨床研究審査委員会にて承認を受けた書類(統括管理者や研究事務局より情報提供された書類)をご提出ください。
- 新規申請
- 変更申請
- 定期報告
- 疾病等報告
- 不適合報告*「病院書式C-02_不適合に関する報告書」を本院で作成いただきます。
- 重大な不適合報告
- 終了報告
- 中止報告
- 厚生労働大臣への実施計画提出報告*「その他報告」より行ってください。
▶︎▶︎▶︎臨床研究法 審査申請システム
(1)臨床研究法審査申請システムご利⽤⽅法について
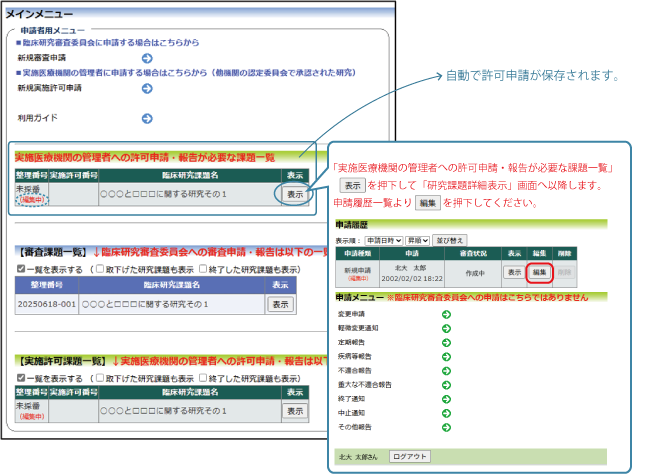
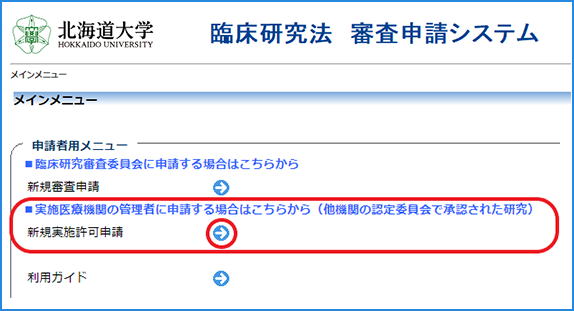
①新規申請の実施許可を得る場合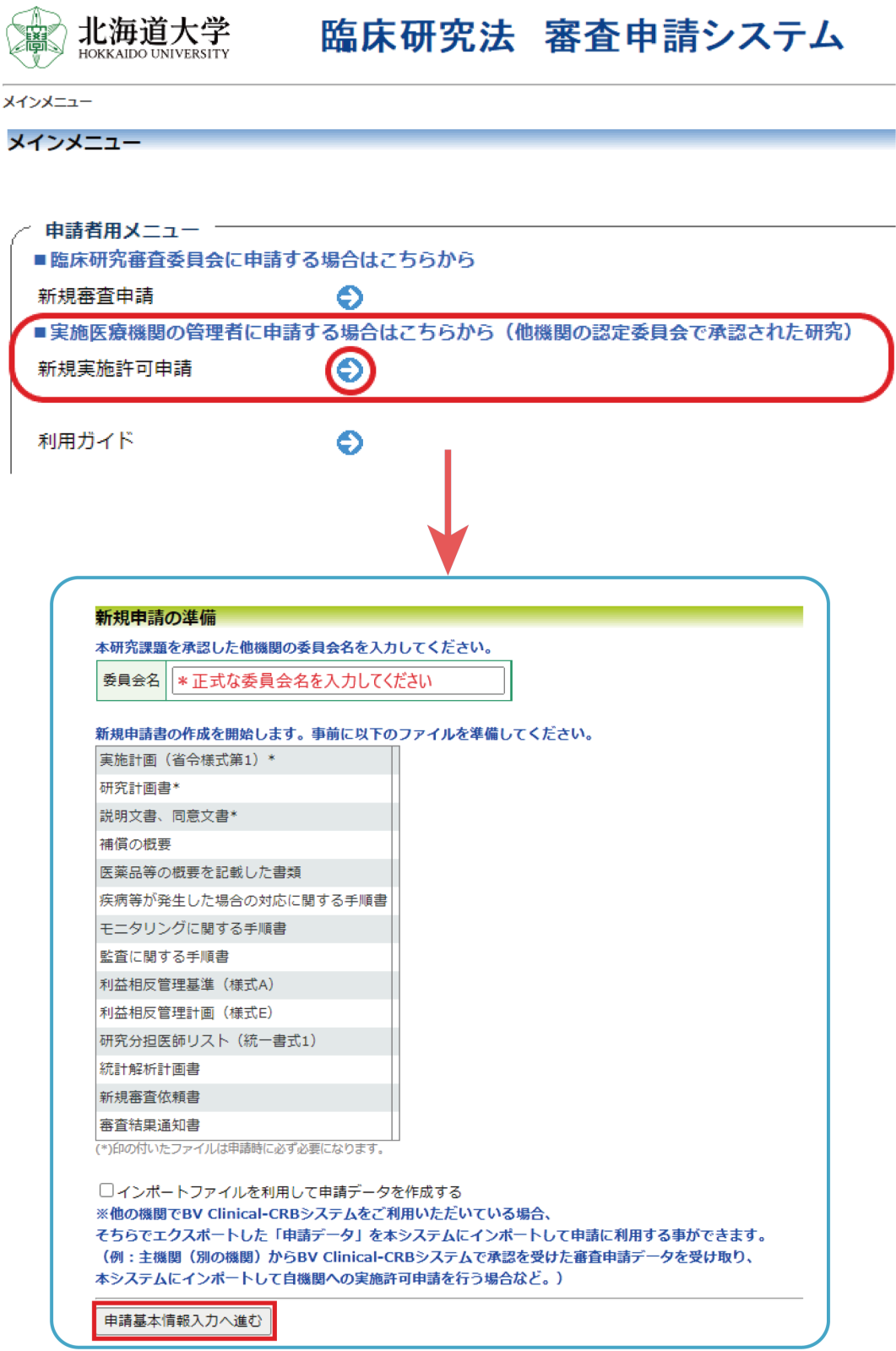
②変更申請、各種報告を行う場合
メインメニューより、申請報告する研究の 表示 をクリックしてください。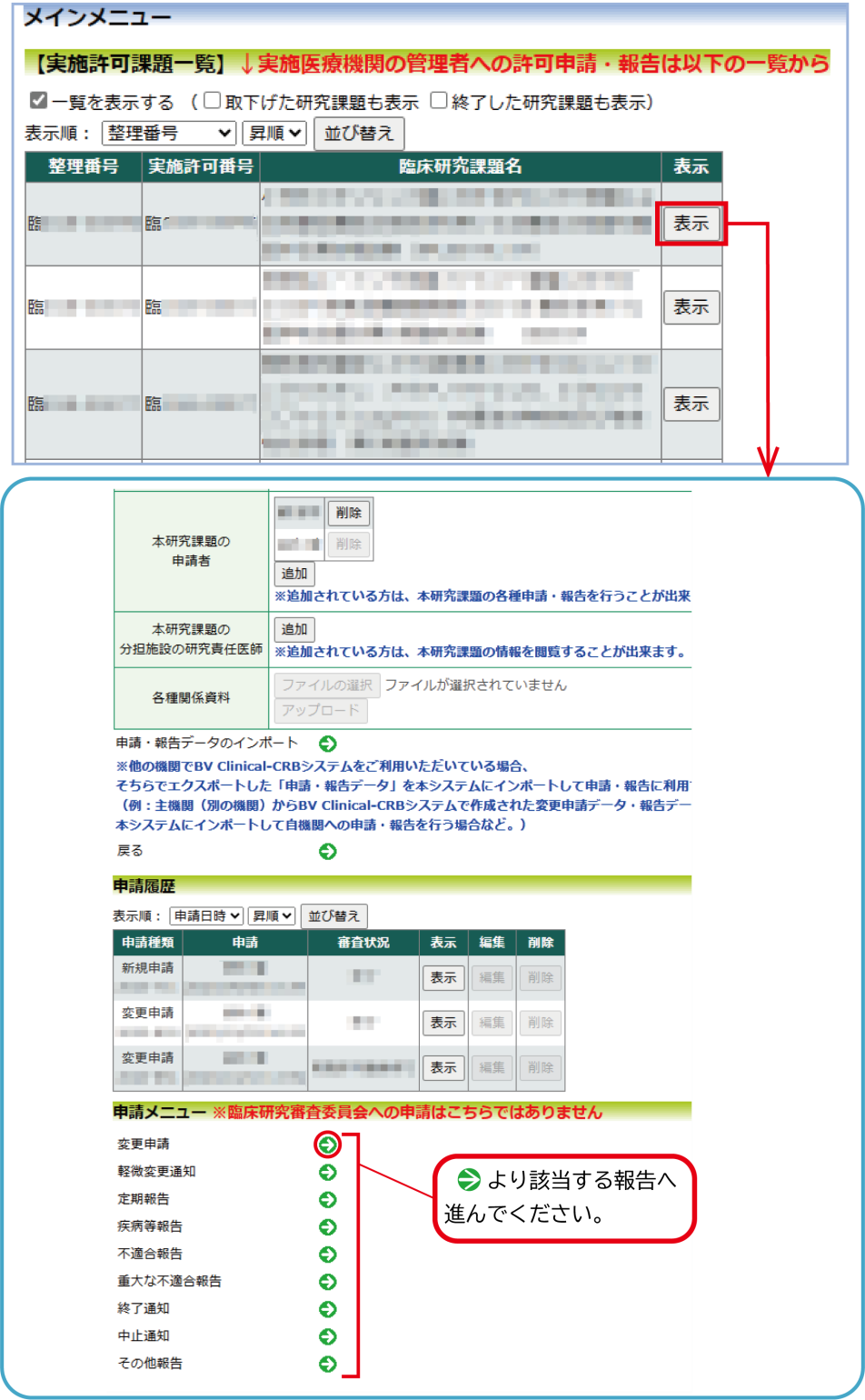
③その他報告
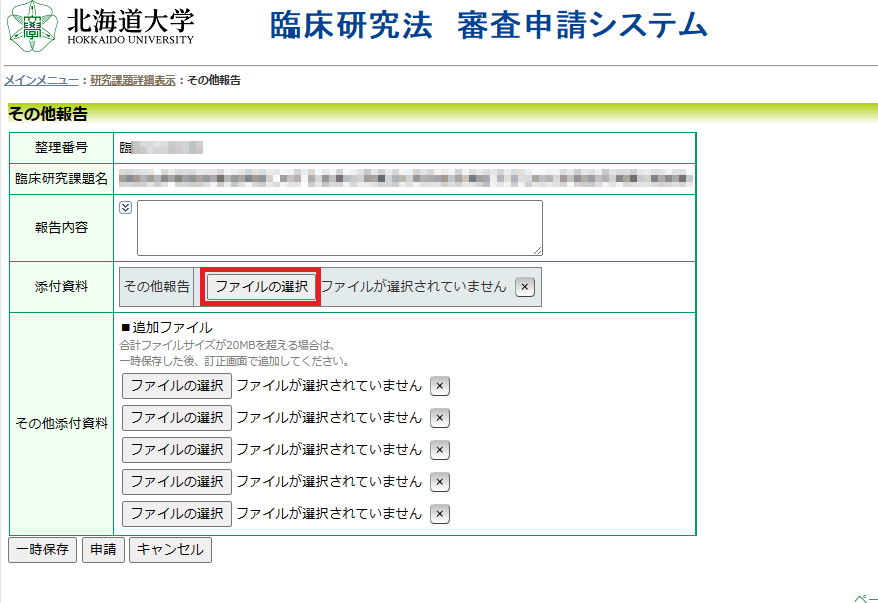
(2) 本学以外の認定臨床研究審査委員会で承認された研究・本学以外の研究代表機関より情報提供された研究は、以下の書類をご提出ください
*研究代表機関へ書類提出前(認定臨床研究審査委員会での審査前)にご確認ください。
▶︎▶︎▶︎ 詳細は利益相反審査委員会事務局までお問い合わせください。
病院長の許可が得られましたら「病院様式C-03 臨床研究に関する決定通知書」はシステムよりPDFでのダウンロードが可能です。
- 実施計画(省令様式第1)
- 研究計画書
- 説明文書、同意文書 *当院用に追記等をおこなった北海道大学病院版もご提出ください
- 補償の概要
- 医薬品等の概要を記載した書類
- 疾病等が発生した場合の対応に関する手順書
- モニタリングに関する手順書
- 監査に関する手順書 *作成した場合に限る
- 利益相反管理基準(様式A)
- 利益相反管理計画(様式E) *上記の注意事項をご確認ください
- 研究分担医師リスト(統一書式1)
- 統計解析計画書 *作成した場合に限る
- 新規審査依頼書(統一書式2)
- 審査結果通知書(統一書式4) *2枚目の承認資料に含まれる書類もご提出ください
・他施設分の利益相反管理計画(様式E)や研究分担医師リスト(統一書式1)が多数含まれる場合はZIPファイルでまとめてご提出いただけます。
病院長の許可が得られましたら「病院様式C-03 臨床研究に関する決定通知書」はシステムよりPDFでのダウンロードが可能です。
- 変更審査依頼書(統一書式3)
- 審査結果通知書(統一書式4) *2枚目の承認資料に含まれる書類もご提出ください
- 認定臨床研究審査委員会で承認された書類一式
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 軽微変更通知書(統一書式6)
- 実施計画事項軽微変更届書 様式第三(第四十三条関係)
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 定期報告書(統一書式5)
- 定期報告書(別紙様式3)
- 審査結果通知書(統一書式4) *2枚目の承認資料に含まれる書類もご提出ください
- モニタリング報告書などモニタリング実施が確認出来る資料 *研究代表機関より提供され、ご提出可能な場合
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 医薬品の疾病等報告書(統一書式8) *医薬品を用いる場合。
- 詳細記載用書式
- 医療機器の疾病等又は不具合報告書(統一書式9) *医療機器を用いる場合。
- 審査結果通知書(統一書式4) *2枚目の承認資料に含まれる書類もご提出ください。
- 疾病等報告書(医薬品)(通知別紙様式2-1) *厚生労働省(PMDA)へ報告した場合。
- 疾病等報告書(医薬機器)(通知別紙様式2-2)*厚生労働省(PMDA)へ報告した場合。
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 不適合に関する報告書
- 審査結果通知書(統一書式4)*審査されている場合
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 重大な不適合報告書(統一書式 7)
- 審査結果通知書(統一書式4) *2枚目の承認資料に含まれる書類もご提出ください。
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 終了通知書(統一書式 12)
- 総括報告書
- 総括報告書の概要*終了届出書(通知別紙様式 1)
- 審査結果通知書(統一書式 4)*2枚目の承認資料に含まれる書類もご提出ください。
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 特定臨床研究中止届書(省令様式第4)
- 中止通知書(統一書式11)
- 審査結果通知書(統一書式4) *2枚目の承認資料に含まれる書類もご提出ください
「病院様式C-03 臨床研究に関する決定通知書」は発行しません。
- 統括管理者や研究事務局からのお知らせ(メールや書類のPDF)
臨床研究法 審査申請システム「その他報告」より行ってください。
研究者の方より臨床研究事務局へよくあるご質問
Q1, 各種報告(定期報告・疾病等報告・重大な不適合報告・終了報告・中止報告)の書類が統括管理者や研究事務局より情報提供されましたが、認定臨床研究審査委員会の審査はまだ行われていない為、審査結果通知書(統一書式 4)が提出できません。
A1, 先に審査結果通知書(統一書式4)を除く他の書類をご提出ください。審査結果通知書(統一書式4)は認定臨床研究審査委員会にて審査され、統括管理者や研究事務局より情報提供されてからご提出いただくことで結構です。
お問い合わせ:臨床研究事務局(臨床研究法担当)
- 011-706-7934
rinsyokenkyu@huhp.hokudai.ac.jp
(※@マークを小文字の「@」へ変更してメールの送信をしてください。)